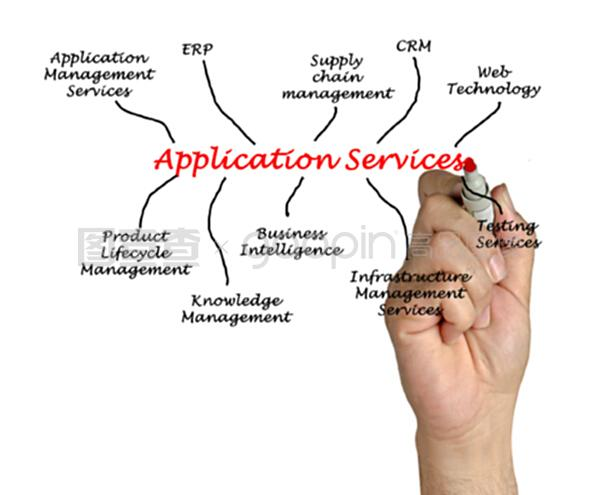
一、地理选修一第三章思维导图
地理选修一第三章的思维导图如下:
1、确定中心主题:确定本章的名称和主要内容作为中心主题,可以使用简洁的语言概括。
2、分级标题:将中心主题展开为一级标题,再根据章节内容将其划分为若干个二级标题。可以使用不同的颜色或形状来区分不同的级别。
3、添加关键词:在每个二级标题下,列出相关的关键词或短语,以便在后续复习时能够快速定位知识点。可以使用不同的颜色或字体来突出重点内容。
4、图形化展示:在思维导图中使用图形、符号、颜色等元素来表达各个主题之间的关系和层次。可以使用不同的形状或颜色来区分不同的知识点,以便更好地理解和记忆。
5、调整和完善:在完成初步的思维导图后,可以对其进行检查和调整,以确保其完整性和准确性。可以根据需要添加或删除节点,调整位置和布局,以便更好地呈现知识点之间的联系和层次。
地理思维导图注意事项:
1、突出重点:在思维导图中使用不同的颜色、字体或符号来突出重点内容和关键词,以便更好地理解和记忆。
2、分级标题:将中心主题划分为若干个二级标题,并使用不同的级别和颜色来区分不同的层次和主题,以便更好地组织和展示知识点。
3、图形化展示:使用图形、符号、颜色等元素来表达各个主题之间的关系和层次,以便更好地理解和记忆。
4、简洁明了:在制作思维导图时,要尽量简洁明了,避免过于复杂和混乱。可以使用简单的语言和图形来表达知识点,以便更好地理解和记忆。
5、关联性与连贯性:确保思维导图中的各个节点和子节点之间有明确的逻辑关系和连贯性。使用箭头、连接线或其他图形元素来表示它们之间的联系和方向。这有助于你更好地理解概念之间的关联和依赖关系。
6、使用颜色和视觉效果:合理运用颜色可以增加思维导图的可读性和吸引力。可以使用不同的颜色来区分不同的主题、子主题或关键词。同时,也可以使用渐变、阴影等视觉效果来突出重要节点或区域。
7、保持平衡:在添加节点和子节点时,要注意保持思维导图的平衡。避免某一部分过于拥挤或复杂,而其他部分过于简单。通过合理分布节点和调整布局,确保思维导图的整体美观和易读性。
8、提供注释和说明:对于一些复杂或晦涩的概念,可以在相应的节点下添加注释或说明。这有助于你更深入地理解相关知识点,并在复习时提供额外的帮助和提示。
9、定期更新和复习:思维导图是一个动态的工具,可以随着你对知识点的理解和掌握程度的提高而不断更新和完善。定期回顾和更新思维导图,添加新的理解、联系和例子,有助于巩固记忆和深化理解。
二、思维导图:高中化学详细资料大全
《思维导图:高中化学(第4次修订)》主要讲述了,思维导图的精髓:促进人类大脑左脑和右脑的合理套用,促进大脑的潜能开发,将大脑的思维过程进行可视化的展示,提高自己的思维水平,改变自己的思维方式和思考模式,让自己用一个开放的头脑接受新鲜的事物,让自己的学习、生活更轻松。思维导图的影响:目前,在国外教育领域,哈佛大学、剑桥大学的学生都在使用思维导图这项思维工具教学;在新加坡,思维导图已经基本成了中小学生的必修课,用思维导图提升智力能力提高思维水平已被越来越多的人认可。
基本介绍
书名 :思维导图:高中化学 出版社 :湖南教育出版社 页数 :416页 开本 :16 品牌 :湖南教育出版社分 作者 :申招斌 出版日期 :2012年8月1日 语种 :简体中文 isbn :9787535554970 内容简介,图书目录, 内容简介
《思维导图:高中化学(第4次修订)》由湖南教育出版社出版。 图书目录
第一部分必修1
第一章从实验学化学
一、化学实验基本方法
二、化学计量在实验中的套用
01物质的量
02阿伏加德罗定律
03以物质的量为核心的换算关系
04有关物质的量浓度计算的关系式
05物质的量在化学方程式计算中的套用
试题检测
第二章化学物质及其变化
一、物质的分类
01物质的组成、性质与变化
02物质分类的方法及规则
03分散系及其分类
04溶液
05胶体
二、离子反应
01电解质、非电解质、强电解质与
弱电解质的比较
02离子反应的类型及规律
03离子方程式
04离子方程式正误的判断
05溶液中离子能否大量共存的判断
三、氧化还原反应
01氧化还原反应的基本概念
02表示氧化还原反应中电子转移
的方法
03氧化还原反应的规律
04常见的氧化剂与还原剂
05氧化性与还原性强弱的判断方法
06氧化还原反应方程式的配平
试题检测
第三章金属及其化合物
一、金属的化学性质
01金属元素在自然界中的存在
02金属的分类
03金属的共性
04金属与非金属的反应
05金属与酸和水的反应
06铝与氢氧化钠溶液的反应
07几种重要金属的化学性质
08金属活动性顺序表所包含的知识
规律和套用
二、几种重要的金属化合物
01钠的化合物
02有关na2o3与co2、h2o的反应
03焰色反应
04铝的化合物
05“铝三角”及其套用
06明矾
07有关氢氧化铝沉淀的相关图示
08铁的化合物
09“铁三角”
三、用途广泛的金属材料
01金属的冶炼
02合金
03金属的回收和资源保护
试题检测
第四章非金属及其化合物
一、无机非金材料的主角——矽
01碳和矽
02二氧化矽
03二氧化碳与二氧化矽的比较
04矽 酸
05矽酸盐
06常见的矽酸盐产品
二、富集在海水中的元素——氯
01氯气
02氯气的制法
03氯元素的化合物的性质
04氯水的成分和性质
05溶液中cl—、co32—检验的比较
三、硫和氮的氯化物
01硫的性质和用途
02二氧化硫的结构、性质和制法
03常见漂白剂的漂白原理的比较
04三氧化硫的结构、性质和制法
05硫化氢的性质
06硫和含硫化合物的相互转化
07硫的氧化物对大气的污染
08氮气的结构、性质及用途
09一氧化氮的结构、性质、制法及用途
10二氧化氮的结构、性质及制法
11氮的氧化物与氧气溶于水的计算
12氮氧化物的来源及对空气的污染
和防治
四、氨硝酸硫酸
01氨的分子结构及性质
02氨水的组成及性质
03铵盐
04氨的制法
05实验室制氨的8点释疑
06硝酸的结构及性质
07硝酸的工业制法——氨催化氧化法
08硝酸的用途
09硫酸的结构、性质与用途
10几种常见的硫酸盐简介
11so42—、so32—与s2—的检验
试题检测
第二部分必修2
第一章物质结构元素周期律
一、元素周期表
01元素周期表
02元素周期表中元素性质的递变规律
03元素周期表中的数字规律
04碱金属元素
05碱金属的结构与性质的关系
06碱金属知识的规律性与特殊性
07 卤族元素
08卤族元素及其化合物的特性
09拟卤素和卤素互化物
10卤素离子的检验
11核素
二、元素周期律
01原子的构成
02核外电子的运动特征
03原子核外电子排布规律
04表示原子结构的常用图示
05元素周期律
06比较元素金属性与非金属性强弱的方法
07元素的“位—构—性”之间的关系
08元素的性质与元素在周期表中位置的关系
09判断粒子半径大小的方法
10周期表中特殊位置的元素
11主族元素性质、存在、用途的特殊性
121~18号元素原子结构的特点归纳
13核外电子数相同的粒子小结
三、化学键
01化学键的相关知识
02离子键和共价键
03离子化合物和共价化合物的比较
04电子式和结构式的书写方法
05分子中的原子是否满足最外层8电子
结构的判断方法
06分子间作用力和氢键
07化学反应的本质
试题检测
第二章化学反应与能量
一、化学能与热能
01化学键与化学反应中能量变化的关系
02化学能与热能的相互转化
03放热反应和吸热反应的比较
二、化学能与电能
01原电池
02原电池的知识规律
03原电池电极反应式的书写技巧
04原电池原理的套用
05化学电源
06可充电电池的反应规律
三、化学反应的速率和限度
01化学反应速率
02化学反应速率的简单计算
03影响化学反应速率的主要因素
04可逆反应
05化学反应的限度
06控制化学反应条件的基本思路
试题检测
第三章有机化合物
一、最简单的有机化合物——甲烷
01有机物概述
02甲烷
03取代反应与置换反应的比较
04烷烃
05同系物与同分异构体
06化学中“四同”的比较
二、来自石油和煤的两种基本化工原料
01乙烯的结构及性质
02乙烯的制法
03乙烯的用途
04烯烃
05苯的分子结构
06苯的来源和性质
07苯的用途
三、生活中两种常见的有机物
01根、基和官能团
02乙醇的结构及性质
03乙醇的用途及制法
04乙酸的结构及性质
05乙酸的制法及用途
四、基本营养物质
01基本营养物质的组成
02糖类的组成与分类
03葡萄糖的结构、性质和用途
04果糖的结构及性质
05蔗糖、麦芽糖的结构、性质及用途
06淀粉、纤维素的组成、性质及用途
07淀粉水解程度的判断
08油脂的组成、结构、性质及用途
09油、脂与酯的比较
10蛋白质的组成、性质及套用
试题检测
第四章化学与自然资源的开发利用
一、开发利用金属矿物和海水资源
01金属矿物的开发利用
02海水资源的开发利用
03海水化学资源的开发利用
二、资源综合利用 环境保护
01煤的综合利用
02石油的综合利用
03天然气的综合利用
04水煤气、天然气、焦炉气、炼厂气、裂解气、石油气的区别
05 以煤、石油和天然气为原料生产合成材料
06环境保护与绿色化学
试题检测
第三部分选修1·化学与生活
第一章关注营养平衡
一、生命的基础能源——糖类
01糖类的来源、主要用途、组成及分类
02糖类代表物的结构、性质及主要套用
二、重要的体内能源——油脂
01油脂的组成、结构、性质及用途
02必需脂肪酸
三、生命的基础——蛋白质
01蛋白质的组成、性质、主要套用及分离与提纯
02胺基酸
03人体必需胺基酸
四、维生素和微量元素
01维生素的种类和性质
02维生素c
03微量元素
第二章促进身心健康
一、合理选择饮食
01水在人体中的作用
02食物的酸碱性
03食品添加剂
二、正确使用药物
01人工合成药物
02天然药物
03几种能成毒品的药物
04正确使用药物
第三章探索生活材料
一、合金
二、金属的腐蚀和防护
01金属腐蚀的本质及类型
02钢铁的电化学腐蚀原理
03金属的防护
三、玻璃、陶瓷和水泥
01传统矽酸盐产品
02玻璃和陶瓷的新发展
03几种材料的性质和用途
四、塑胶、纤维和橡胶
01塑胶
02纤维
03橡胶
04复合材料
05新型材料
第四章保护生存环境
一、改善大气质量
二、爱护水资源
01水体污染物的种类
02改善水质的根本措施
03污水处理的方法
三、垃圾资源化
01垃圾处理的基本原则
02垃圾处理的主要方法
03 白色污染
04电池垃圾的危害与治理
05垃圾的利用
第四部分选修2·化学与技术
第一章走进化学工业
一、化工生产过程中的基本问题
01化工生产过程中的基本问题
02接触法制硫酸
二、人工固氮技术——合成氨
01合成氨的反应原理
02合成氨的生产流程
03合成氨适宜条件的选择
04化学模拟生物固氮
三、纯碱的生产
01氨碱法
02侯德榜制碱法(联合制碱法)
第二章化学与资源开发利用
一、获取洁净的水
01除去水中的悬浮物和胶体
02杀菌
03化学软化法
二、海水的综合利用
三、石油、煤和天然气的综合利用
第三章化学与材料的发展
一、无机非金属材料
01传统矽酸盐材料
02新型无机非金属材料
二、金属材料
01钢铁的工业冶炼
02铝的冶炼
03金属的腐蚀和防护
三、高分子化合物与材料
01有机高分子化合物
02合成有机高分子的途径——加成聚合反应
03合成有机高分子的途径——缩合聚合反应
04性能优异的合成材料
05环境中的高分子材料
第四章化学与技术的发展
一、化肥和农药
01常见化肥的实例、生产原理、特点和用途
02农药
……
第五部分选修3·物质结构与性质
第六部分选修4·化学反应原理
第七部分选修5·有机化学基础
第八部分化学实验基础
第九部分高考题型解法板块
附录
三、高中重要有机化学方程式与思维导图
高中化学是理科中的一门课程,涵盖着比较多、杂,要想学好高中化学,不仅需要掌握好 方法 ,还要对各个知识点掌握牢固。我在这里整理了高中重要有机化学方程式相关资料,希望能帮助到您。
高中重要有机化学方程式
甲烷
甲烷燃烧
ch4+2o2→co2+2h2o(条件为点燃)
甲烷隔绝空气高温分解
甲烷分解很复杂,以下是最终分解。ch4→c+2h2(条件为高温高压,催化剂)
甲烷和氯气发生取代反应
ch4+cl2→ch3cl+hcl
ch3cl+cl2→ch2cl2+hcl
ch2cl2+cl2→chcl3+hcl
chcl3+cl2→ccl4+hcl(条件都为光照。)
实验室制甲烷ch3coona+naoh→na2co3+ch4(条件是cao加热)
乙烯
乙烯燃烧ch2=ch2+3o2→2co2+2h2o(条件为点燃)
乙烯和溴水ch2=ch2+br2→ch2br-ch2br
乙烯和水ch2=ch2+h20→ch3ch2oh(条件为催化剂)
乙烯和氯化氢ch2=ch2+hcl→ch3-ch2cl
乙烯和氢气ch2=ch2+h2→ch3-ch3(条件为催化剂)
乙烯聚合nch2=ch2→-[-ch2-ch2-]n-(条件为催化剂)
氯乙烯聚合nch2=chcl→-[-ch2-chcl-]n-(条件为催化剂)
实验室制乙烯ch3ch2oh→ch2=ch2↑+h2o(条件为加热,浓h2so4)
乙炔
乙炔燃烧c2h2+3o2→2co2+h2o(条件为点燃)
乙炔和溴水c2h2+2br2→c2h2br4
乙炔和氯化氢两步反应:c2h2+hcl→c2h3cl--------c2h3cl+hcl→c2h4cl2
乙炔和氢气两步反应:c2h2+h2→c2h4→c2h2+2h2→c2h6(条件为催化剂)
实验室制乙炔cac2+2h2o→ca(oh)2+c2h2↑
以食盐、水、石灰石、焦炭为原料合成聚乙烯的方程式。
caco3=== cao + co2 2cao+5c===2cac2+co2
cac2+2h2o→c2h2+ca(oh)2
c+h2o===co+h2-----高温
c2h2+h2→c2h4----乙炔加成生成乙烯c2h4可聚合
苯
苯燃烧2c6h6+15o2→12co2+6h2o(条件为点燃)
苯和液溴的取代c6h6+br2→c6h5br+hbr
苯和浓硫酸浓硝酸c6h6+hno3→c6h5no2+h2o(条件为浓硫酸)
苯和氢气c6h6+3h2→c6h12(条件为催化剂)
乙醇
乙醇完全燃烧的方程式c2h5oh+3o2→2co2+3h2o(条件为点燃)
乙醇的催化氧化的方程式2ch3ch2oh+o2→2ch3cho+2h2o(条件为催化剂)(这是总方程式)
乙醇发生消去反应的方程式ch3ch2oh→ch2=ch2+h2o(条件为浓硫酸170摄氏度)
两分子乙醇发生分子间脱水2ch3ch2oh→ch3ch2och2ch3+h2o(条件为催化剂浓硫酸140摄氏度)
乙醇和乙酸发生酯化反应的方程式ch3cooh+c2h5oh→ch3cooc2h5+h2o
乙酸
乙酸和镁mg+2ch3cooh→(ch3coo)2mg+h2
乙酸和氧化钙2ch3cooh+cao→(ch3ch2)2ca+h2o
乙酸和氢氧化钠ch3cooch2ch3+naoh→ch3coona+ch3ch2oh
乙酸和碳酸钠na2co3+2ch3cooh→2ch3coona+h2o+co2↑
醛类
甲醛和新制的氢氧化铜hcho+4cu(oh)2→2cu2o+co2↑+5h2o
乙醛和新制的氢氧化铜ch3cho+2cu(oh)2=ch3cooh+cu2o+2h2o
乙醛氧化为乙酸2ch3cho+o2→2ch3cooh(条件为催化剂或加温)
物质制备方法
乙炔的实验室制法:cac2+2h2o→ca(oh)2+c2h2↑
实验室制甲烷ch3coona+naoh→na2co3+ch4(条件是cao加热)
实验室制乙烯ch3ch2oh→ch2=ch2↑+h2o(条件为加热,浓h2so4)
实验室制乙炔cac2+2h2o→ca(oh)2+c2h2↑
工业制取乙醇:c2h4+h20→ch3ch2oh(条件为催化剂)
乙醛的制取
乙炔水化法:c2h2+h2o→c2h4o(条件为催化剂,加热加压)
乙烯氧化法:2ch2=ch2+o2→2ch3cho(条件为催化剂,加热)
乙醇氧化法:2ch3ch2oh+o2→2ch3cho+2h2o(条件为催化剂,加热)
乙酸的制取
乙醛氧化为乙酸:2ch3cho+o2→2ch3cooh(条件为催化剂和加温)
其他反应
加聚反应:
乙烯聚合nch2=ch2→-[-ch2-ch2-]n-(条件为催化剂)
氯乙烯聚合nch2=chcl→-[-ch2-chcl-]n-(条件为催化剂)
氧化反应:
甲烷燃烧ch4+2o2→co2+2h2o(条件为点燃)
乙烯燃烧ch2=ch2+3o2→2co2+2h2o(条件为点燃)
乙炔燃烧c2h2+3o2→2co2+h2o(条件为点燃)
苯燃烧2c6h6+15o2→12co2+6h2o(条件为点燃)
乙醇完全燃烧的方程式c2h5oh+3o2→2co2+3h2o(条件为点燃)
乙醇的催化氧化的方程式2ch3ch2oh+o2→2ch3cho+2h2o(条件为催化剂)
乙醛的催化氧化:ch3cho+o2→2ch3cooh(条件为催化剂加热)
甲烷和氯气发生取代反应
ch4+cl2→ch3cl+hcl
ch3cl+cl2→ch2cl2+hcl
ch2cl2+cl2→chcl3+hcl
chcl3+cl2→ccl4+hcl
(条件都为光照。)
苯和浓硫酸浓硝酸c6h6+hno3→c6h5no2+h2o(条件为浓硫酸)
乙酸乙酯的水解:ch3cooc2h5+h2o→ch3cooh+c2h5oh(条件为无机酸式碱)
乙烯和溴水ch2=ch2+br2→ch2br-ch2br
乙烯和水ch2=ch2+h20→ch3ch2oh(条件为催化剂)
乙烯和氯化氢ch2=h2+hcl→ch3-ch2cl
乙烯和氢气ch2=ch2+h2→ch3-ch3(条件为催化剂)
乙炔和溴水c2h2+2br2→c2h2br4
乙炔和氯化氢两步反应:c2h2+hcl→c2h3cl--------c2h3cl+hcl→c2h4cl2
乙炔和氢气两步反应:c2h2+h2→c2h4---------c2h2+2h2→c2h6(条件为催化剂)
苯和氢气c6h6+3h2→c6h12(条件为催化剂)
乙醇发生消去反应的方程式ch3ch2oh→ch2=ch2+h2o(条件为浓硫酸170摄氏度)
两分子乙醇发生分子间脱水2ch3ch2oh→ch3ch2och2ch3+h2o(条件为催化剂浓硫酸140摄氏度)
化学最全 思维导图
高中重要有机化学方程式相关 文章 :
1. 高中有机物化学方程式汇总
2. 高中化学有机物重要知识笔记
3. 高中化学记忆9种方法,有机化学复习策略
4. 高二化学方程式记忆技巧
5. 高二选修五化学方程式总汇